| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 产品价格 |
| 293-77601 | MagCapture™ Exosome Isolation Kit PS Exosome外泌体提取试剂盒PS |
10次用 | - | - |
| 299-77603 | MagCapture™ Exosome Isolation Kit PS Exosome外泌体提取试剂盒PS |
2次用 | for Genetic Research | – |
| 016-27061 | Anti CD63, Monoclonal Antibody (3-13) 抗CD63单抗(3-13) |
20uL | – | – |
| 012-27063 | Anti CD63, Monoclonal Antibody (3-13) 抗CD63单抗(3-13) |
100uL | – | – |
| CAC-SHI-EXO-M02-50UL | Anti CD63 for Exosome Isolation CD63 外泌体提取抗体 |
50uL | – | – |
| CAC-SHI-EXO-M01-100UL | Anti CD9 for Exosome Isolation 外泌体分离抗体CD9 |
100uL | – | – |
| CAC-SHI-EXO-M02-100UL | Anti CD63 for Exosome Isolation 外泌体分离抗体CD63 |
100uL | – | – |
| CAC-SHI-EXO-M03-100UL | Anti CD81 for Exosome Isolation 外泌体分离抗体CD81 |
100uL | – | – |
| CSR-SHI-EXO-K010 | ExoTrap ™ Exosome Isolation Spin Column Kit, for Protein Research 外泌体分离亲和柱套装,蛋白研究用 |
kit | – | – |
| 290-35591 | Magnet Stand MagCapture系列磁珠捕获用磁力架 |
1个 | – | – |
- 产品特性
- 相关资料
- Q&A
- 参考文献
 新型亲和法外泌体提取试剂盒
新型亲和法外泌体提取试剂盒
MagCapture™ 外泌体提取试剂盒PS
MagCapture™ 外泌体提取试剂盒 PS采用磷酯酰丝氨酸(PS)亲和Tim4蛋白固化磁珠(PS亲和法)的方法可以简便快捷地提取高纯度的完整外泌体和其他细胞外囊泡(EVs)。如果想要得到更高纯度的外泌体,请使用10,000×g离心后的上清。
该试剂盒使用含有EDTA的中性洗脱缓冲液将外泌体完整洗脱下来,所提取的完整外泌体和其他EVs可用于不同实验,包括电镜分析(TEM)、纳米粒子追踪(NTA)分析、投喂实验、分子组成(蛋白质、脂质、核酸等)分析等。
◆膜表面磷酯酰丝氨酸(PS)亲和法

Tim4蛋白固化磁珠,在金属离子存在的条件下亲和细胞外囊泡表面的磷酯酰丝氨酸(PS),然后使用含有EDTA的洗脱液进行洗脱,捕获高纯度的完整细胞外囊泡
◆优点・特色

使用新型亲和提取方法
|
● 通过PS亲和分子回收 ● 低背景值 ● 在中性条件下通过螯合试剂进行温和洗脱 ※ 可获得高纯度,完整的外泌体 |
|
无需进行超离
● 使用磁珠改进了操作
● 流程优化
※ 高重复性
|
与其他提取方法相比 |
||||
|
方法 |
外囊泡纯度 |
囊泡状态 |
可操作性 |
回收量 |
|
PS亲和法 |
■■■ |
完整 |
简便稳定 |
■■■ |
|
超速离心法 |
■■ |
完整 |
简便 |
■■ |
|
聚合物沉淀法 |
■ |
完整 |
简便快捷 |
■■■■ |
|
密度梯度离心法 |
■■■■ |
完整 |
复杂 |
■■ |
|
抗体亲和法 |
■■■ |
不完整 |
简便稳定 |
■■ |
样品类型:细胞培养上清、血清、血浆、尿液等。
● 可以纯化高纯度和完整的细胞外囊泡
● 可以从细胞上清液、血清、血浆和尿液中纯化外囊泡
● 重复性高,回收量稳定
● 简易操作(约3.5小时)
● 启用多个样品(无需超速离心)
◆产品列表
|
产品名称 |
包装规格 |
保存条件 |
|
|
MagCapture™ |
10次 (产品编号:293-77601) |
2次 (产品编号:299-77603) |
2-10°C |
|
试剂盒成分 (1) 链霉亲和素磁珠 |
<10 次> |
<2 次> |
|
*每套试剂盒能完成5次回收实验,即实际使用量为10×5次/Kit与2×5次/Kit
◆案例•应用
从血清、血浆、尿液中提取的细胞外囊泡的分析
从人血清中提取外泌体的产量比较
使用该试剂盒,超离法和抗体亲和法提取人血清的外泌体,接着用CD9和CD63抗体进行免疫印迹实验。

● 检测抗体
抗CD9兔多抗,System Bioscience公司
抗CD63兔多抗,System Bioscience公司
● 免疫印迹(WB)数据
各样品结果相当于150μL的血清样本。从100μL提取物中取出15μL,添加5μL的4×SDS样品缓冲液,全部上样。
从人EDTA血浆中提取外泌体
分别从1mL的EDTA血浆、EDTA血浆(超滤更换缓冲液)、人血清中提取外泌体,进行WB检测(抗Flotillin2抗体)。

● 检测抗体
抗Flotillin-2小鼠单抗(29/Fotillin-2),BD Bioscience公司
● 使用样品量
各1mL
● 免疫印迹(WB)数据
各样品结果分别对应150μL样品量。从100μL提取物中取出15μL,添加5μL的 4×SDS样品缓冲液,全部上样。
从人尿液中提取外泌体的回收量比较
1mL人尿液分别通过本试剂盒、聚合物沉淀法、超离法进行外泌体回收,并做免疫印迹(WB)检测(抗CD9抗体)。
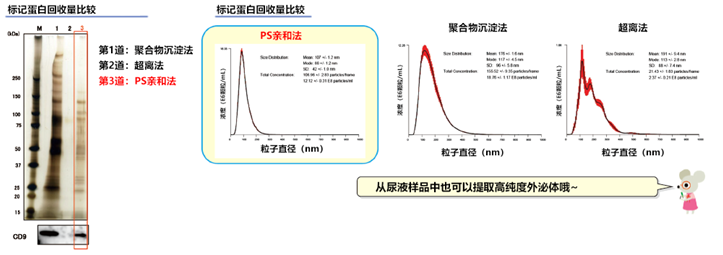
● 检测抗体
抗CD9兔多抗,System Biosciences公司
● 使用样品量
各1mL
● 免疫印迹(WB)数据
各样品结果分别对应150μL尿液样品。从100μL提取物中取出15μL,加入5μL的 4×SDS样品缓冲液,全部上样。
◆与传统沉淀法的功能比较实验
分别用本试剂盒、超离心法和聚合物沉淀法从K562(人慢性骨髓性白血病)细胞培养上清(无血清培养上清或10%Exosome-depleted FBS添加培养基)提取外泌体,分别比较三种方法的外泌体回收量和外泌体纯度。
MagCapture™ 外泌体提取试剂盒PS【PS亲和法】
按照试剂盒的操作说明(反应时间:3小时),从1mL经过离心处理(10,000×g,30min)的K562细胞培养上清(无血清培养基或10% Exosome-depleted FBS添加培养基※1)中提取外泌体。
超速离心法
将10mL经过离心处理(10,000×g,30min)的K562细胞培养上清(无血清培养基或10% Exosome-depleted FBS添加培养基※1)进行超离(110,000×g,70min),用TBS缓冲液重悬沉淀物后,再进行超离(110,000×g,70min),回收沉淀部分。
聚合物沉淀法
从1mL经过离心处理(10,000×g,30min)的K562细胞培养上清(无血清培养基或10% Exosome-depleted FBS添加培养基※1)中,按照市售的A公司产品的操作说明(静置时间:过夜)提取外泌体。
※1:110,000×g离心2小时,在不吸到沉淀的前提下回收上清。
比较提取的外泌体的透射电子显微镜(TEM)分析结果和纳米粒子追踪(NTA)分析结果
分别用本试剂盒、超离法、聚合物沉淀法提取外泌体,用NanoSight LM10检测外泌体片段的粒子直径。另外,用最终浓度为2%的多聚甲醛固定提取到的外泌体片段(2~4×1010 particles),在透射电子显微镜进行分析。

电子显微镜图像 数据提供:金泽大学 医学系 华山教授、大阪大学 iFReC 中井先生
MagCapture™可提取到很多100nm左右的粒子,在透射电子显微镜中也可以确认到很多细胞外囊泡。
K562细胞培养上清提取的外泌体回收量和纯度的比较(无血清培养基)
用PS亲和法、超离法和聚合物沉淀法从K562 细胞培养上清(无血清培养基)获得样品进行电泳。接着用银染色和WB法(CD63, Flotilin-2和Lamp-1抗体)进行实验。
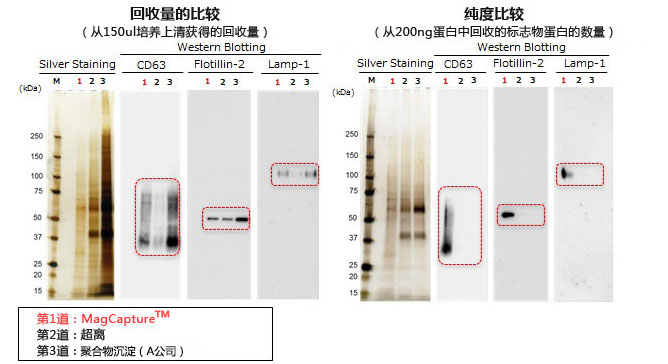

回收量,不是回收率
● 检测抗体
抗CD63小鼠单抗(MEM-259)
抗Flotillin-2 小鼠单抗 (29/Flotillin-2),BD Bioscience公司
抗Lamp-1小鼠单抗 (25/Lamp-1),BD Bioscience公司
K562细胞培养上清提取外泌体的回收量和纯度的比较(10%FBS-添加培养基)
用MagCapture™外泌体提取试剂盒 、超离法和聚合物沉淀法,从K562 细胞培养上清(10% 去外泌体 FBS补充培养基)获得样品进行电泳,用银染法和WB法(CD63、Lamp-1和Flotilin-2抗体)进行实验。同时,对外泌体提取片段进行质谱测定,比较所有测定的多肽中来自K562细胞的人来源多肽的比例(由于添加到细胞培养基的FBS中牛蛋白聚集体是混杂的,所以人来源多肽的比率会下降)。
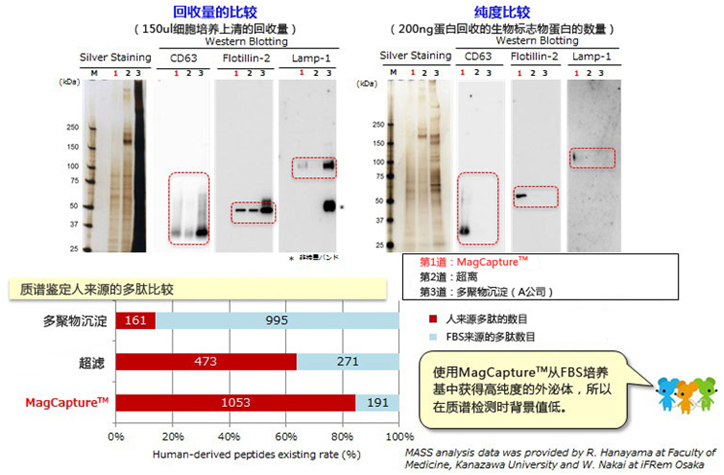
● 检测抗体
抗CD63小鼠单抗(MEM-259)
抗Flotillin-2小鼠单抗 (29/Flotillin-2),BD Bioscience公司
抗Lamp-1小鼠单抗(25/Lamp-1),BD Bioscience公司
健康人血清来源的外泌体中提取miRNA和mRNA的回收量比较
实验数据
①运用不同方法提取外泌体并比较从中提取的microRNA和mRNA的回收量
通过超离法和PS亲和法将EVs从正常人血清中分离,然后使用microRNA提取试剂盒(产品编号295-71701)提取RNA。通过qRT-PCR分析提取的RNA,并比较microRNA (let-7a, miR-16, miR-92a, miR-142-3p)、mRNA (GAPDH, PIK3CB)的Ct值。
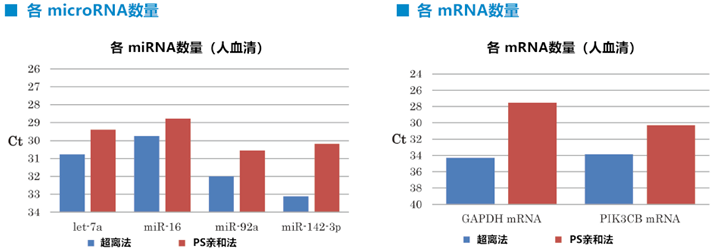
相比超离法,PS亲和法提取所得EVs中的microRNA和mRNA得到更高产量。
②运用不同的RNA提取方法提取microRNA和mRNA的回收量比较
运用PS亲和法将EVs从正常人血清中分离,然后使用microRNA提取试剂盒(产品编号295-71701)或基于AGPC法的试剂提取RNA。通过qRT-PCR分析提取的RNA,并比较microRNA (let-7a, miR-16, miR-92a, miR-142-3p)、mRNA (GAPDH, PIK3CB)的Ct值。
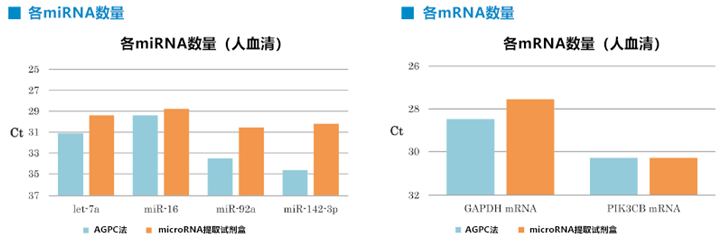
对比AGPC法,使用microRNA提取试剂盒更能有效提取PS亲和法纯化所得EVs中的microRNA和mRNA
◆外泌体蛋白质组学分析
<实验内容及结果>
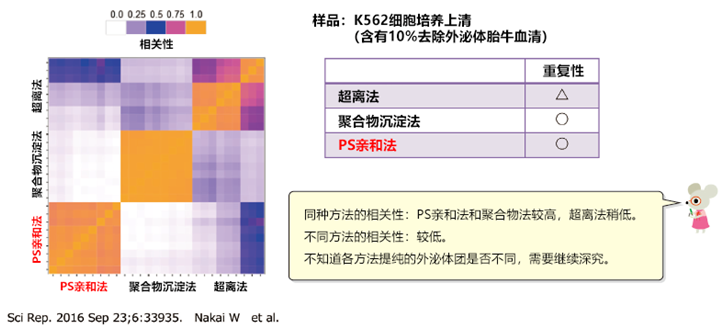
分别利用PS亲和法、超离法、聚合物沉淀法,从含10% FBS(不含外泌体)的K562细胞培养上清液中提取外泌体。将提取样品用10%聚丙烯酰胺电泳分离,剪切出全部的蛋白质条带。然后在凝胶内进行消化,用LC-MS对蛋白质进行检测。对上述三种方法提取的外泌体进行蛋白质组合的相关性比较。
比较通过MASS分析鉴定的前10个蛋白质
白色柱:源自外囊泡的人类蛋白质
灰色柱:来自FBS的牛蛋白污染物
红 色:来自外囊泡的标记蛋白
样品:K562细胞培养基(含有10%去除外泌体胎牛血清)
|
PS亲和法 |
超离法 |
聚合物沉淀法 |
|
|
1 |
71kDa热休克同源蛋白 (Heat shock cognate 71kDa protein) |
DNA依赖蛋白激酶催化亚基基因 (DNA-dependent protein kinase catalytic subunit) |
补体C3 (Complement C3) |
|
2 |
膜联蛋白A6 (Annexin A6) |
铁转蛋白受体1 (Transferrin receptor protein1) |
α2-巨球蛋 (Alpha-2-macroglobulin) |
|
3 |
铁转蛋白受体1 (Transferrin receptor protein1) |
血清白蛋白 (Serum albumin) |
纤连蛋白 (Fibronectin) |
|
4 |
V-ATP酶A亚基 (V-type proton ATpase catalytic subunit A) |
ATP依赖RNA解旋酶 (ATP-dependent RNA helicase A) |
血清白蛋白 (Serum albumin) |
|
5 |
浮舰蛋白-2 (Flotillin-2) |
微管蛋白β5 (Tubulin beta-5 chain) |
血小板反应蛋白-1 (Thrombospondin-1) |
|
6 |
程序性细胞死亡6互作蛋白(Programmed cell death 6-interacting protein) |
71kDa热休克同源蛋白 (Heat shock cognate 71kDa protein) |
补体C4 (Complement C4) |
|
7 |
细胞表面抗原4F2重链 (4F2 cell-surface antigen heavy chain ) |
脂肪酸合成酶 (Fatty acid synthase) |
α-1抗蛋白酶 (Alpha-1-antiproteinase) |
|
8 |
膜联蛋白A1 (Annexin A1) |
细胞表面抗原4F2重链 (4F2 cell-surface antigen heavy chain) |
载脂蛋白-β-100 (Apolipoprotein-β-100) |
|
9 |
220kDa激酶D相互作用底物 (Kinase D-interacting substrate of 220kDa) |
U5小核核糖核蛋白的解旋酶 (U5 small nuclear ribonucleoprotein helicase) |
胎儿血红蛋白亚单位 (Hemoglobin fetal subunit beta) |
|
10 |
膜联蛋白A2 (Annexin A2) |
β4微管蛋白 (Tubulin beta-4B chain) |
β5微管蛋白 (Tubulin beta-5 chain) |

成对组合相关性比较
◆应用数据
Protein Assay BCA Kit检测外泌体的蛋白质浓度
Protein Assay BCA Kit是利用二辛可宁酸(BCA)定量检测溶液中的蛋白质浓度的试剂盒,是蛋白质定量检测法中最通用的方法。其原理为,碱性条件下的蛋白质Cu2+离子被还原为Cu+。Cu+与BCA形成络合物,即产生紫色螯合物,蛋白质浓度与紫色螯合物颜色深浅有关,通过测定562nm处的吸光度,并与标准曲线做比照,即可定量溶液中的蛋白质浓度。
利用MagCapture™外泌体提取试剂盒从细胞培养上清液中提取外泌体,通过Protein Assay BCA Kit高灵敏的检测外泌体中蛋白质浓度。
【实验内容及结果】
将通过MagCapture™外泌体提取试剂盒提取的25μL外泌体溶液分注于96孔板中,加入 Protein Assay BCA Kit中试剂A和试剂B混合液200μL。之后60℃孵育30分钟,检测560nm吸光度(图1)。结果表明,通过Protein Assay BCA Kit的高灵敏度检测,可测定提取后外泌体中蛋白质浓度。
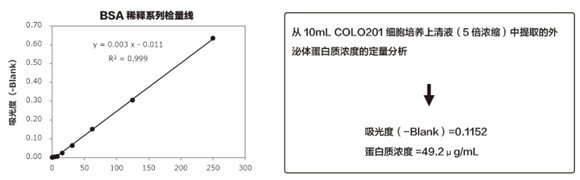
图1. Protein Assay BCA Kit 检测BSA的检量线和提取的外泌体蛋白质浓度的检测
<BCA Assay 操作概要>
由于外泌体蛋白质浓度相当低,因此BCA测定时不要稀释样品。
① 将BSA标准溶液按照250、125、62.5、31.25、15.625μg/mL和空白对照,分别每孔25μL加到96孔板中。
② 分别把提取的外泌体和洗脱缓冲液(空白)按照每孔25μL加入96孔板。
③ 把200μL Protein Assay BCA Kit(产品编号:297-73101)的试剂A盒试剂B混合液(A:B=50:1)加入放有样品的孔板中。
④ 60℃孵育30分钟
⑤ 室温条件下降低孔板温度
⑥ 测定560nm的吸光度
|
产品编号 |
产品名称 |
包装 |
|
297-73101 |
Protein Assay BCA Kit 蛋白测定试剂盒(二喹啉甲酸) |
250次用 |
|
015-25613 |
2 mg/mL Albumin Solution from Bovine Serum 2mg/mL 牛血清蛋白溶液 |
1mL×10 |
◆外泌体的标记和Hela细胞导入实验
【实验概要】
用PKH67(Sigma公司)标记MagCapture™ 外泌体提取试剂盒提取的细胞外囊泡, Hela细胞导入确认
<外泌体PKH67标记>
1. MagCapture™ 外泌体提取试剂盒提取外泌体(实验当天从K562细胞培养上清液提取外泌体)
2. 用BCA Assay和NanoSight检测样品的蛋白质浓度和粒子浓度
3. 将相当于5μg*蛋白量的外泌体样品溶液分装至1.5mL管中。
*请配制合适的使用量
4. 将2.0μL的PKH linker溶解在0.25mL的DiluentC中。…4×Dye solution*
*请配制合适的使用量
5. 添加1/3样品量的4×Dye solution至样品中,混合后在室温中孵育5-10分钟。
6. 根据附带的操作说明用PBS平衡Exosome Spin Columns (MW 3000)(Thermo公司)。
7. 将100μL样品分别加入上述平衡后的旋转柱*中,离心(最大添加量:100μL)。
*准备必需的支数。
8. 将外泌体溶液*加入到已经接种好Hela细胞的培养皿中,24小时后用显微镜观察并利用流式细胞仪进行分析。
*根据实验调节外泌体添加量
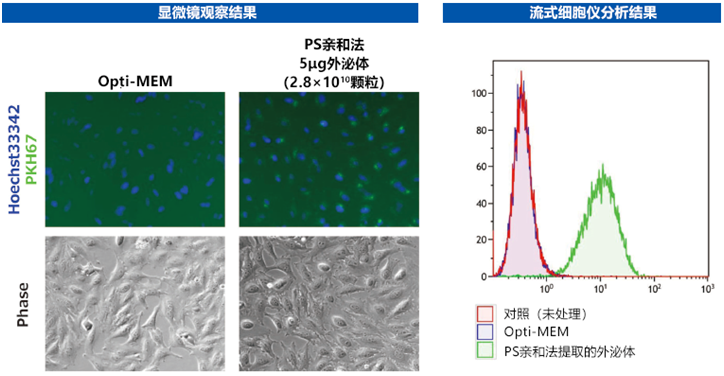
图1. PKH标记外泌体的细胞捕获观察
从16mL K562培养上清液中超滤浓缩得到4mL培养上清液作为样品,通过PS亲和法提取外泌体。
● 提取的外泌体蛋白质浓度:22.3ng/μL
● 粒子浓度:1.2×108 particles/mL
将上述标记的外泌体溶液全部加入接种好的Hela细胞中,24小时后用荧光显微镜(左)和流式细胞仪(右)检测捕获情况。
Opti-MEM:取相同量用PKH标记后添加到细胞中作为阴性对照。

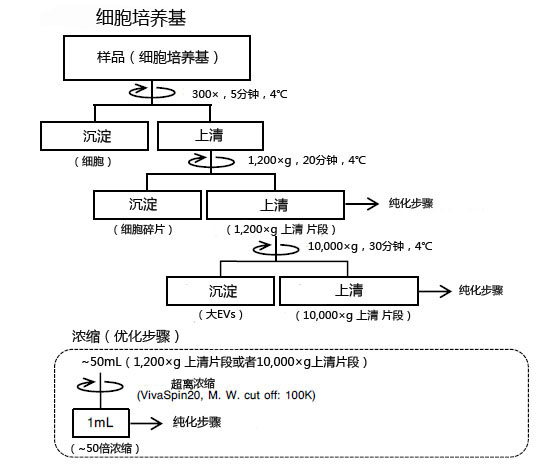
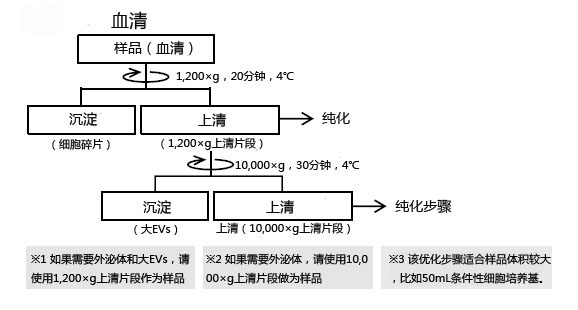
◆细胞培养上清•血清•血浆的预处理操作
样品预处理:对样品进行1,200×g离心操作※1。如果要得到更高纯度的外泌体,则按照下述步骤对样品进行10,000×g离心操作※2。
下文是细胞培养上清、血清/血浆的预处理方法。其他体液样品的预处理操作,请参考血清/血浆的实验步骤,做适当调整。
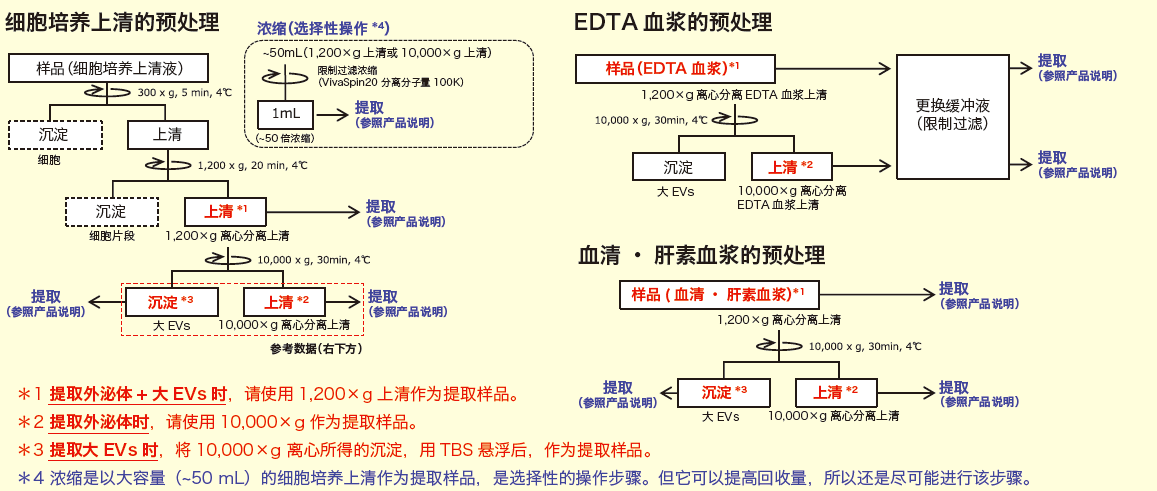
更换缓冲液(限制过滤)操作
用50 mL TBS 缓冲液对1 mL 已经经过离心处理的EDTA 血浆样品进行缓冲液更换。
1. 把19 mL TBS 加进VivaSpin20(100K)中。
2. 把1 mL 离心过的EDTA 血浆上清添加在第1. 的VivaSpin20(100K)中,
混匀。
3. 把第2. 的VivaSpin20(100K)在4℃下进行离心处理。
4. 减少上线的液体后,在VivaSpin20(100K)中追加10 mL TBS 缓冲液。
5. 4℃下离心处理。
6. 减少上面的液体后,在VivaSpin20(100K)中追加10 mL TBS 缓冲液。
7. 4℃下离心处理。
8. 减少上面的液体后,在VivaSpin20(100K)中追加11 mL TBS 缓冲液。
9. 4℃下离心处理直至样品液量达到1 mL 以下。
10. 进行提取。
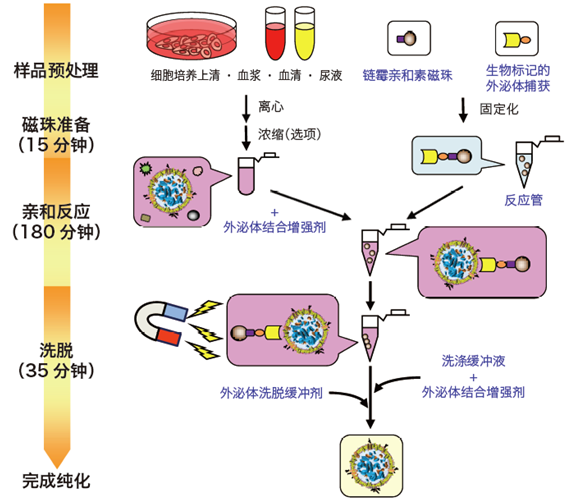
◆MagCapture™ 外泌体提取试剂盒 操作步骤
更多应用说明,请点击:
新型亲和性外泌体纯化法与外泌体高灵敏度检测应用
外泌体与肿瘤细胞转移及恶化的关联
欲了解相关产品请点击文字:
EV-Save™ 细胞外囊泡封闭试剂
MagCapture™ 外泌体提取试剂盒PS操作视频
PS Capture™ 外泌体ELISA试剂盒(抗小鼠IgG POD)
Wako外泌体相关抗体CD63单克隆抗体
MagCapture™ 系列用磁珠捕获磁力架
PS Capture™ 外泌体流式试剂盒
相关资料
Wako 外泌体相关产品
Wako 外泌体册子
【相关资料】
PS亲合法
通过使用T细胞免疫球蛋白结构域和粘蛋白域包含蛋白4(Tim4)分离高度纯化的外泌体。Tim4是在巨噬细胞上表达的I型跨膜蛋白,其强烈结合磷酯酰丝氨酸,不仅显示在凋亡细胞上,而且显示在外泌体和微泡。使用Tim4蛋白,其特异性结合显示在外泌体表面上的磷酯酰丝氨酸。因为结合是Ca2+依赖性的,完整的外泌体可以通过添加Ca2+螯合剂容易地从Tim 4释放。值得注意的是,利用PS亲和法提取的外泌体纯度之高可以用过质谱显示的。还用于从细胞条件培养基沉淀中分离大外泌体和通过ELISA、流式细胞术对外泌体的灵敏定量。这些结果表明通过Tim4蛋白纯化的有用性表征Evs的真正功能。
(Wataru Nakai, Takeshi Yoshida, Diego Diez etl.A novel affinity-based method for the isolation of highly purified extracellular vesicles[J]Nature, Scientific Reports 6, Article number: 33935 (2016). doi:10.1038/srep33935)
|
和光外泌体提取试剂盒宣传页 |
Wako外泌体英文版说明书.pdf |
|
|
|
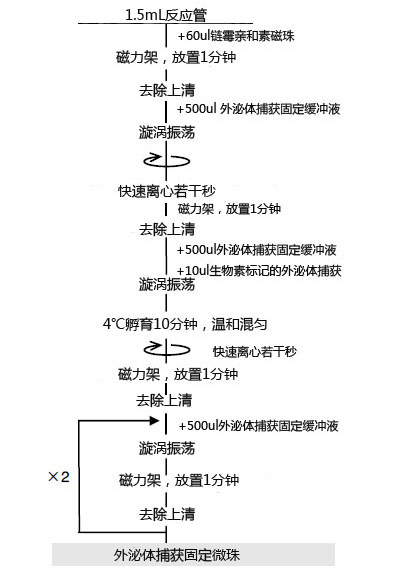
操作流程
样品制备流程(步骤1)
外泌体捕获固定流程(步骤2)
亲和提取流程(步骤3—5)

外泌体提取血浆样品前处理步骤
使用TBS缓冲液进行缓冲液交换
1、向VIVASPIN 20(100K)中添加19mL TBS缓冲液。
2、将1ml血浆添加到(步骤1)的VIVASPIN 20(100K)中并混合。
3、离心(步骤2)中的VIVASPIN 20(100K)。 (离心条件参考使用说明书)
4、当上层液体下降时,添加10mL TBS缓冲液到(步骤3)的VIVASPIN 20(100K)中。
5、离心。
6、当上层液体下降时,添加10mL TBS缓冲液到(步骤5)的VIVASPIN 20(100K)中。
7、离心。
8、当上层液体下降时,添加11mL TBS缓冲液到(步骤7)的VIVASPIN 20(100K)中。
9、离心VIVASPIN 20(100K),直到样品体积变为1mL。
该方案共计使用50mL的TBS缓冲液。
MagCapture™ 外泌体提取试剂盒
常见问题
• 关于试剂盒的规范、性能
Q1 本试剂盒使用了抗体吗?
A1 没有使用抗体。使用了与金属离子结合和与磷酯酰丝氨酸(PS)结合的蛋白。
Q2 用此款试剂盒可提取什么样的细胞外囊泡呢?
A2 外泌体和大型细胞外囊泡(微小泡)。
Q3 外泌体和微泡的区别是?
A3 外泌体,是来源于晚期胞内体,直径为40-100nm的细胞外囊泡。微泡来源于细胞膜,直径100-1000nm的细
胞外囊泡。
Q4 外泌体和微泡能可以分别纯化吗?
A4 可以。同时纯化的情况下,1200×g离心取上清液。纯化外泌体的情况下,10000×g离心取上清液。只纯化微
泡的情况下,10000×g离心,沉淀置于TBS制成悬浊液备用。样品的前处理请参考操作说明书。
Q5 外壳型病毒也能回收吗?
A5 能。外壳性病毒膜表面也有PS,混入外壳性病毒的样品,所有PS都能回收。需要分离的情况下,使用本试剂盒
回收后,需要用与病毒或者外泌体特异性抗原的抗体纯化。
Q6 所有的外泌体都会暴露磷脂酰丝氨酸(PS)吗?
A6 尚未得到实验验证。通过分析外泌体的膜脂成分证实,有几种细胞(小鼠少突胶质细胞)来源于外泌体。因
此,不会暴露PS。另一方面有可能存在少量PS暴露的外泌体,而此款试剂不能纯化这种外泌体。但是,使用
该试剂纯化到的外泌体,已确认有多个外泌体标记蛋白,与以单一类型的表面标记蛋白作为抗原的传统亲和方
法相比,以膜脂成分为抗原的该试剂能取得更多种类的外泌体。另外,虽然识别表面标记蛋白的抗体可能无法
识别不同动物来源的抗原,但是该试剂能解决这一问题(人类、小鼠、牛等都能应用)。而且已验证了可以纯
化超速离心时需沉淀才能回收的外泌体。
Q7 该试剂盒的样品是什么?
A7 使用细胞培养上层清液、血清或尿液效果显著。如果血浆中添加了螯合剂(比如EDTA)和柠檬酸,原理上无
法分离外泌体。若要回收,可通过超滤更换缓冲液来回收。具体步骤请看相关资料。由于肝素处理过的血浆回
收率低,从血液样本中回收请使用血清。另外有客户成功从血浆、脑脊髓液中回收外泌体。
Q8 一次能回收多少外泌体?
A8 根据样品的种类和数量有很大的差异,据研究所实验记录,在一次的分离中最多能回收30μg蛋白质(通过
BCA法检测)、1-2×1010粒子(通过纳米技术检测)。(K562培养基中的莫能菌素能促进外泌体分泌,可取
5mL培养上清液进行回收)。
1 mL正常人混合血清能回收5×109颗粒(通过纳米技术检测)。
• 与传统法的比较
Q9 与超速离心法相比好处在哪?
A9 与超速离心法相比,本试剂盒能更简便、重复性好、高效地回收高纯度外泌体。也能回收超速离心法无法沉淀
的外泌体。
Q10 与传统抗体亲和法相比,PS亲和的优势是什么?
A10 采用传统的抗体亲和法是用变性剂进行洗脱,此款试剂盒是在中性环境下用螯合剂来洗脱的,能完整回收外
泌体,不会混入非特异性吸附物,能获得高纯度外泌体,提取纯度更高。传统的抗体亲和法只能特异性识别
一种外泌体表面Marker蛋白质,而本试剂盒是特异性识别膜脂质成分,更能广泛获得外泌体。有事例表明识
别表面Marker蛋白质抗体不能识别不同动物物种的抗原,而本试剂盒能在大范围的动物物种中运用(人,
小鼠,牛等都有报道)。
Q11 与其他方法相比回收的纯度如何?
A11 与传统沉淀法(超速离心法、多聚物沉淀法)相比,纯度更高。与超速离心法和密度梯度离心法相结合的方
法相比,能简便地获得同等高纯度的外泌体。(原因:采用抗体的传统亲和法是用变性剂进行洗脱,因此很
容易混入粒子等非特异性吸附物。然而此款试剂盒是用螯合剂来洗脱的,所以难以混入非特异性吸附物。)
Q12 与其他方法相比回收率如何?
A12 与采用抗体的传统亲和法、超速离心法相比,能获得更高的回收率(低于聚合物沉淀法)。
• 关于试剂盒的操作方法、组成
Q13 操作该试剂盒耗时多久?
A13 (1个小时预处理样品),该试剂盒Exosome Capture磁珠的固定需要15分钟,然后3个小时的化学反应,
最后15分钟洗脱,总计3小时30分钟。
Q14 本试剂盒需要特别慎重的操作吗?
A14 Exosome Capture固定化磁珠与样品反应后的清洗步骤中最后需要去除洗净液。完全去除后再进行提取。
提取时在提取液中加入磁珠后,确保磁珠不发生凝集并处于悬浮状态。
Q15 提取液的组成有哪些?
A15 是含有1mM的螯合剂、盐、防腐剂的Tris基础溶液。若以上成分阻碍后续分析,请使用超速离心膜
(Sartorius公司 VivaSpin500,使用100K分子量截留,Code:VS0141)并替换合适的Buffer。
Q16 Exosome Capture 固定后磁珠可以循环利用吗?
A16 可以。为了能够高效回收样品中的外泌体,试剂盒可完成5次回收实验。试剂盒里的缓冲液只含5次纯化的
量。1mL体积以上样本建议进行浓缩后再回收,纯化时可进行反复抽提,提高纯化效率。详情参考操作说
明书。
Q17 Exosome Capture固定化磁珠能保存吗?
A17 可以。洗脱出外泌体后的磁珠需再使用,用试剂盒附带的 Washing buffer或自制的TBS冷藏保存。
Q18 实验要留到第二天需要做什么步骤?
A18 Exosome Capture固定化磁珠与样品的反应步骤(反应时间3小时)可以过夜(置于4℃下)。
• 关于样品用量
Q19 样品纯化所需的最低量是?
A19 使用旋转器的需要500μL以上,使用离心管混合器的需要100μL。样品量更少的情况下加TBS到所需最低量后
再使用Exosome Capture固定化磁珠。
Q20 大量的样品能回收吗?
A20 可浓缩后再回收。如果样品是培养上清,可以从体积50毫升的样品中回收外泌体。离心分离预处理后,取
50mL上清液超离浓缩至1mL(推荐Sartorius Viva Spin20 使用100K分子量截留、Code:VS2041)。无
血清培养基和添加了10% FBS的培养基也可以收集外泌体。详情参照操作说明书。因为血清样品无法浓缩,
最多只能用10mL的样品。但是大于1mL的血清回收率低,建议反复提纯。
• 关于外泌体提取后的分析
Q21 外泌体中含有什么?
A21 含有蛋白质、脂质、核酸(DNA、microRNA、mRNA)等。
Q22 提取后的细胞外囊泡可以用什么方法检测?
A22 因为能得到完整的细胞外囊泡,可以使用所有的分析方法。
(例)蛋白质分析:蛋白质电泳、免疫印迹、质谱分析、流式细胞术、ELISA等
核酸分析如:定量PCR、微阵列(生物芯片)、新一代测序等
粒子分析:电镜分析,纳米位点分析(NTA)等
功能分析:体内外的用药实验等
Q23 提取后的细胞外囊泡(EVs)能直接添加到细胞使用中吗?
A23 可以使用,但有需要注意的地方。如果提取液的成分有影响,参考Q15替换合适的Buffer。使用离心过滤
部件。
(Millipore公司ΜLtrafree – MC, GV 0.22μm 已灭菌、Code:UFC30GV0S)除菌。
Q24 电镜分析需要外泌体的量是多少?
A24 能用电镜观察到2-4×1010的粒子(通过纳米技术检测)。
Q25 提取出的细胞外囊泡的保存条件是?
A25 冷藏、冷冻保存。长期保存需要放到-80℃。
为避免冻结溶解,冻结保存推荐细分后保存。
Q26 如何做回收的外泌体提取液的免疫印迹?
A26 本公司研究所从回收的100 μL提取液抽取15 μL,加入5 μL 4×SDS样品Buffer,共20μL的样品全量上样进行
SDS-PAGE。用量与宣传册上的免疫印迹的样本量一致。
Q27 Exosome质谱检测的步骤是?
A27 外泌体提取→SDS-PAGE与胶内酶切→通过LC-MC/MS进行蛋白质组学分析
• 关于外泌体标记
Q28 用该试剂盒提取出来的囊泡怎么判断是外泌体呢?
A28 根据表面抗原的抗体(WB)、电子显微镜、密度梯度离心、纳米粒度测量(如NanoSight LM10)等来
验证。
Q29 外泌体分离后用免疫印迹法确认的标记蛋白是什么?
A29 CD9, CD63, CD81, Frotillin-2, Lamp-1等。
• 相关产品
Q30 有在销售和光检测外泌体用的抗体吗?
A30 本公司当前销售以下抗体。
Anti CD9 for Exosome Isolation(Cosmo Bio Cat. NO.CAC-SHI-EXO-M01-50UL)
Anti CD81 for Exosome Isolation(Cosmo Bio Cat. NO.CAC-SHI-EXO-M03-50UL)
Anti CD63, Monoclonal Antibody (3-13)(Wako Cat. NO.012-27063)
Anti CD63, Monoclonal Antibody (3-13)(Wako Cat. NO.016-27061)
Q31 有可以从分离囊泡里提纯RNA的试剂盒吗?
A31 有。可使用microRNA Extractor SP Kit(295-71701)比AGPC法更能高效提纯RNA。
Q32 有销售磁支架吗?
A32 有的。Wako品牌,产品编号290-35591,MagCapture系列磁珠捕获用磁力架。”
Q33 该技术专利是什么?
A33 已申请PCT专利。
Q34 加入什么金属离子?
A34 钙离子
Q35 血浆提取方法是?
A35 请查看相关资料。
Q36 试剂盒中的22支反应管有什么特殊之处吗?用普通的1.5mL离心管可以吗?
A36 该试剂盒中的反应管使用特殊材质,可减少磁珠吸附,该反应管可单卖
A36 BMBio BM-15 Ring Lock Tube 1.7mL 500 tubes/box 1。
|
[1] |
W. Nakai, et al, Sci Rep 6, 33935 (2016). A novel affinity-based method for the isolation of highly purified extracellular vesicles. PMID: 27659060 |
|
[2] |
A. Kraft, W81 Award. Regulating Cancer-Associated Fibroblast Biology in Prostate Cancer (2017). |
|
[3] |
S. Osawa et al, Biochem. Biophys. Res. Commun., 232-238 (2017). Fibronectin on extracellular vesicles from microvascular endothelial cells is involved in the vesicle uptake into oligodendrocyte precursor cells. PMID: 28499870 |
|
[4] |
S. Nagashima et al, , J. Virol., 91(22) e00822-17 (2017). Characterization of the Quasi-Enveloped Hepatitis E Virus Particles Released by the Cellular Exosomal Pathway. PMID: 28878075 |
|
[5] |
T. Yoshida et al, Curr. Protoc. Cell Biol., 11;777:3.45.1-3.45.18 (2017). High Purity Isolation and Sensitive Quantification of Extracellular Vesicles Using Affinity to TIM4. PMID: 29227551 |
|
[6] |
S. Saito et al, Sci Rep 8, 3997 (2018). Glycome analysis of extracellular vesicles derived from human induced pluripotent stem cells using lectin microarray. PMID: 29507392 |
|
[7] |
H. Kobayashi et al, Nagoya J Med Sci., 80(2), 141-153 (2018). Effects of exosomes derived from the induced pluripotent stem cells on skin wound healing. PMID: 29915432 |
|
[8] |
Y. Obata, et al., JCI Insight 3(8), 99680, (2018) Adiponectin/T-cadherin system enhances exosome biogenesis and decreases cellular ceramides by exosomal release. PMID: 29669945 |
|
[9] |
RC. Middleton, et al., J Extracell Vesicles 7(1) 1456888 (2018). Newt cells secrete extracellular vesicles with therapeutic bioactivity in mammalian cardiomyocytes. PMID: 29696078 |
|
[10] |
H. Kawahara, et al., Biol. Pharm. Bull. 41, 1119–1125 (2018). The Role of Exosomes/Extracellular Vesicles in Neural Signal Transduction. PMID: 30068858 |
|
[11] |
M. Santiana, et al., Cell Host & Microbe 24, 208–220 (2018). Vesicle-Cloaked Virus Clusters Are Optimal Units for Inter-organismal Viral Transmission. PMID: 30092198 |





