| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 产品价格 |
| MUC01 | Tear Mucin Assay Kit (O-Glycan Assay Method | 1 KIT [50TEST] |
- 产品特性
- 相关资料
- Q&A
- 参考文献
本试剂盒的原理是在碱性条件下,O-聚糖通过β氢脱离反应从核心蛋白中脱离的同时,在糖链还原末端标记荧光,根据荧光强度检测泪液中的粘蛋白含量。
◆背景
粘蛋白是泪液和眼表上皮顶端细胞膜的主要组分,由O-糖链结合核心蛋白而成。其中,核心蛋白是由10-80氨基酸残基,通过高度O-糖基化的丝氨酸和苏氨酸残基串联重复结构域而组成。,而具有亲水性质的O-聚糖占粘蛋白重量的一半以上(图1)。重糖基化的粘蛋白具有高负电荷和亲水性,该特性具有阻止病原体粘附或穿透进入上皮的功能(图2)。干眼病患者眼表面粘蛋白及其分泌均发生改变(图2)。在眼表上皮,存在三种类型的粘蛋白,由结膜杯状细胞表达的大凝胶形成的粘蛋白MUC5AC,一些来自泪腺腺泡的细胞表达小溶性粘蛋白MUC7,角膜和结膜上皮细胞表达膜相关粘蛋白MUC1,4和16(图2)。

图1 粘蛋白的构造
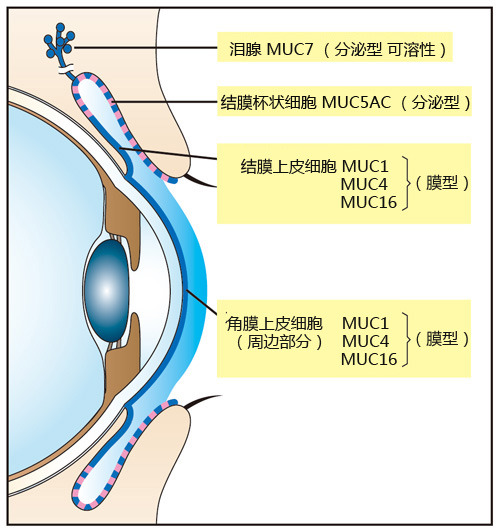
图2 围绕在角膜表面的粘蛋白表达以及泪液粘蛋白的屏障功能

图3 泪液粘蛋白的防护机能
泪液中粘蛋白的减少被认为是干眼症的病因。泪液中的粘蛋白可大致分为两大类,分别是分泌型粘蛋白以及膜型粘蛋白(图2)。分泌型粘蛋白包括MUC5AC(由结膜杯状细胞分泌)、MUC7(由泪腺分泌);膜型粘蛋白包括MUC1、MUC4、MUC16(存在于角膜上皮的细胞膜上)等。
◆特点
● 本试剂盒的原理是在碱性条件下,O-聚糖通过β氢脱离反应从核心蛋白中脱离的同时,在糖链还原末端标记荧
光,根据荧光强度检测泪液中的粘蛋白含量。
● 使用检测泪液量的泪液分泌试纸可检测泪液中粘蛋白的含量。
● 可用于针对干眼症等眼部问题的药物及保健食品的研发以及眼科相关研究。
◆试剂盒组成
|
NO. |
组成 |
规格 |
数量 |
贮存温度 |
|
1 |
提取液 |
30mL |
1 |
4~10℃ |
|
2 |
凝胶过滤载体 |
45mL |
1 |
|
|
3 |
标准液 (100 µg/mL N-乙酰) |
1.0 mL |
1 |
|
|
4 |
试剂 A |
0.3 mL |
1 |
|
|
5 |
试剂 B |
1.5 mL |
1 |
|
|
6 |
反应停止液 |
15 mL |
1 |
|
|
7 |
空柱 |
1 mL用 |
50 |
|
|
8 |
离心管 |
- |
50 |
该试剂盒包含检测数目泪液黏蛋白所有组件
◆应用
用于测定泪液中粘蛋白含量。
◆测定原理
粘蛋白属于高分子(1000kda-10000kda)重糖基化蛋白家族,主要由富含苏氨酸与丝氨酸的核心蛋白组成。糖链N-乙酰半乳糖胺(GalNAc)的还原末端与翻译后的O-糖基化氨基酸连接(图1)。在碱性条件下,O-聚糖通过β氢脱离反应从核心蛋白中脱离的同时,在高温下糖链还原末端与2-氰基乙酰胺(2-CAN)反应产生强烈荧光缩合物,根据荧光强度检测泪液中的粘蛋白含量。
◆检测步骤
● 本产品专为荧光(96孔板)测量而设计。
● 使用荧光读板机可以测量100个样品。
● 使用分光光度计测量时,请使用微细胞。
样品制备
● 使用Schirmer氏泪液分泌条收集泪液5分钟。
● 储存泪液分泌条收集的泪液时,请放入微量试管中,并在4℃保存,同时避免冻结。
泪液粘蛋白的测定
1、将泪液分泌条转移至微量试管中,加入200μL缓冲液洗脱,并在室温下提取粘蛋白1小时。
2、在步骤1的1小时内,准备空柱,并将空柱放入离心管中。搅拌凝胶浆液至均匀后,将800μL凝胶浆液加入到空柱 中,并在室温下以800×g离心10分钟,(推荐使用具有摆动转子系统的离心机。),去除管中底部液体。
3、将步骤1用泪液分泌条提取的50μL粘蛋白加入到步骤2凝胶的上部。
4、在室温下以800×g离心加有样品的柱子10分钟,并收集过滤的样品组分(约50μL)。
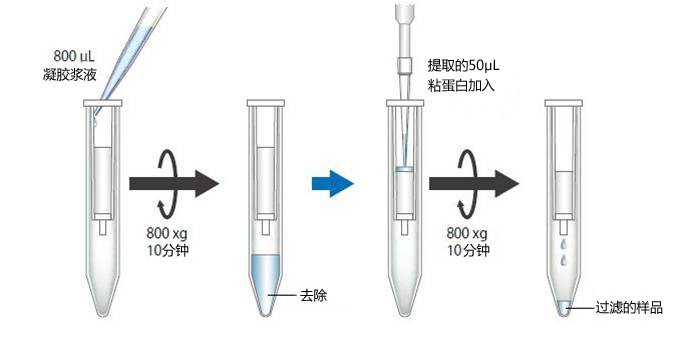
5、将每次通过的组分(4)或标准溶液(①〜⑧)的20uL转移到另一个微量试管(500uL)中。在试管中加入24uL 混合试剂(使用前,将试剂A和试剂B以1:5的体积混合)。混合后,将试管加热至100℃30分钟。
6、将试管冷却至室温后,加入200uL终止溶液,并用涡旋混合器混匀。
7、将100μL溶液放入96孔黑色孔板中,设置波长(荧光:336nm,发射:383nm)后用荧光读板机测量。
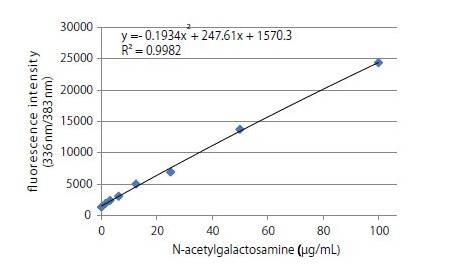
8、按照如下稀释浓度创建标准曲线。
构建校准曲线,并从标准曲线中读取样品浓度。
标准曲线:
参考数据:
建议测量Ex时使用336nm波长,测量Em时使用383nm,但使用具有干涉滤光片系统的荧光板作为前导时,可能无法测量荧光波长,这种情况下,需将荧光波长调到较长数值。
相关产品信息请点击:粘蛋白检测试剂盒
[1]Gipson IK, Hori Y, Argüeso P. Character of ocular surface mucins and their alteration in dry eye disease.(2004)Ocul Surf., Apr;2(2):131-48
[2]Argüeso P, Balaram M, Spurr-Michaud S, Keutmann HT, Dana MR, Gipson IKGipson IK et al., Decreased levels of the goblet cell mucin MUC5AC in tears of patients with Sjögren syndrome. (2002) Invest Ophthalmol Vis Sci, April; 43(4): 1004-11
[3]Uchino Y, Uchino M, Yokoi N, Dogru M, Kawashima M, Okada N, Inaba T, Tamaki S, Komuro A, Sonomura Y, Kato H, Argüeso P, Kinoshita S, Tsubota, Alteration of tear mucin 5AC in office workers using visual display terminals: The Osaka Study. (2014) JAMA Ophthalmol., Aug;132(8):985-92
[4]natomi T, Spurr-Michaud S, Tisdale AS, Zhan Q, Feldman ST, Gipson IK. Expression of secretory mucin genes by human conjunctival epithelia. (1996) Invest Ophthalmol Vis Sci., Aug;132(8):985-92
[5]Susumu Honda, Yoshikazu Matsuda, Masaye Takahashi, and Kazuaki Kakehi Fluorimetric Determination of Reducing Carbohydrates with2-Cyanoacetamide and Application to Automated Analysis of Carbohydrates as Borate Complexes. (1980) Analytica Chimica, Vol. 52, No. 7
[6]Crowther RS, Wetmore RF: Fluorometric assay of O-linked glycoproteins by reaction with 2-cyanoacetamide. Anal Biochem 163: 170-174, 1987.
[7]Okazaki Y, Han Y, Kayahara M, Watanabe T, Arishige H, Kato N. Consumption of curcumin elevates fecal immunoglobulin A, an index of intestinal immune function, in rats fed a high-fat diet. J Nutr Sci Vitaminol (2010); 56(1): 68-71.
[8]Yukako Okazaki, Hiroyuki Tomotake, Kazuhisa Tsujimoto, Masahiro Sasaki,and Norihisa Kato. Consumption of a Resistant Protein, Sericin, Elevates Fecal Immunoglobulin A, Mucins, and Cecal Organic Acids in Rats Fed a High-Fat Diet. (2011) The Journal of Nutrition , 21, 10.3945/ jn.111.144246.
[9]Zaki Utama & Yukako Okazaki & Hiroyuki Tomotake & Norihisa Kato, Tempe Consumption Modulates Fecal Secondary Bile Acids, Mucins, Immunoglobulin A, Enzyme Activities, and Cecal Microflora and Organic Acids in Rats. Plant Foods Hum Nutr (2013) 68: 177–183
