| |
| |
|
|
| |
| |
| ■ 制品内容 (100 次量*1) |
| AMV Reverse Transcriptase XL (5 U/μl) (来源于Avian Myeloblastosis Virus) |
50 μl |
| RNase Inhibitor*2 (40 U/μl) |
25 μl |
| Random 9 mers*2 (50 pmol/μl) |
50 μl |
| Oligo dT-Adaptor Primer (2.5 pmol/μl) |
50 μl |
| RNase Free dH2O |
1 ml |
| TaKaRa LA Taq (5 U/μl) |
25 μl |
| M13 Primer M4*2 (20 pmol/μl) |
50 μl |
| 10X RNA PCR Buffer |
120 μl |
| 100 mM Tris-HCl (pH8.3) |
|
| 500 mM KCl |
|
| 10X LA PCR Buffer II (Mg2+ Free) |
500 μl |
| dNTP Mixture (各10 mM) |
150 μl |
| MgCl2 (25 mM) |
1 ml |
| Control F-1 Primer*2 (20 pmol/μl) (Positive Control RNA下游引物) |
25 μl |
| Control R-1 Primer*2 (20 pmol/μl) (Positive Control RNA上游引物) |
25 μl |
Positive Control RNA*2 (2 × 105 copies/μl)
(Transcribed poly(A)+ RNA of pSPTet3 plasmid) |
25 μl |
| |
*1:本试剂盒可用于100次反应 (总反应量:RT 反应10 μl, PCR反应 50 μl)
*2:【各种引物序列】 |
|
| |
| 引物名称 |
各引物序列 |
|
Random 9 mers
|
5′-NNNNNNNNN-3′ |
|
Oligo dT-Adaptor Primer
|
包含dT区域及M13 Primer M4序列。 |
|
Control F-1 Primer
|
5′-CTGCTCGCTTCGCTACTTGGA-3′ |
|
Control R-1 Primer
|
5′-CGGCACCTGTCCTACGAGTTG-3′ |
|
M13 Primer M4
|
5′-GTTTTCCCAGTCACGAC-3′ |
|
|
| |
| *3:【Positive Control RNA】 |
| 本试剂盒中的Control RNA是以pSPTet3质粒 (质粒中的SP6启动子下游插入长约1.4 kbp的pBR322来源的DNA片段,其DNA片段上含有抗四环素基因) 为模板由SP6 RNA聚合酶经体外转录而得到的。Control RNA (约1.4 kb) 是带有30个A碱基的具有Poly(A)+ 尾的RNA。当把Control RNA经RT-PCR合成的双链cDNA插入质粒时,该质粒便可获得四环素抗性。Control RNA简图见图1。 |
| |
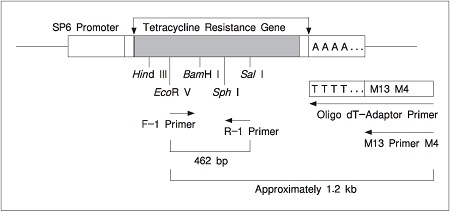 |
| 图1. Positive Control RNA:使用各种引物所能扩增的DNA片段 |
| |
| |
| ■ 制品说明 |
|
TaKaRa RNA LA PCR Kit (AMV) Ver.1.1使用TaKaRa LA Taq酶,实现反转录后的更长更准确的PCR反应。TaKaRa LA Taq酶是Takara Bio公司研制的LA (long and accurate) PCR*反应的关键组成。
本试剂盒利用LA Technology的优势特点,用AMV (Avian Myeloblastosis Virus) 来源的反转录酶,由RNA反转录至cDNA,然后再在同一反应管中用TaKaRa LA Taq扩增此cDNA,操作简单,使用方便。本试剂盒中的Oligo dT-Adaptor Primer的特别设计,使从Poly (A)+ RNA 3’端合成cDNA的效率更高,从而可以利用3’-RACE法高效扩增RNA的3′端未知区域。
*:U.S.Patent 5,436,149 for LA Technology is owned by TAKARA BIO INC. |
| |
|
| ■ 保存 |
| -20℃。 |
| |
| ■ 特点 |
|
RNA模板
|
适用于所有RNA |
|
扩增片段大小
|
~12 kb |
|
反转录酶
|
AMV Reverse Transcriptase (反转录反应温度在42℃~60℃) |
|
DNA Polymerase
|
TaKaRa LA Taq |
|
RNase Inhibitor
|
试剂盒中含有 |
|
合成cDNA第一条链的引物
|
Random 9 mers或Oligo dT-Adaptor Primer或特异性下游PCR Primer 可供选择 |
|
3′-RACE法
|
RT反应时使用Oligo dT-Adaptor Primer
PCR反应时下游引物使用M13 Primer M4 |
|
操 作
|
在同一反应管中进行 (反转录酶在进行PCR反应前须进行高温失活) |
|
|
| |
| ■ 使用注意 |
1. 当同时需要进行多个反转录反应或PCR反应时,应先配制各种试剂的混合液 (其中包括RNase Free dH2O、Buffer、dNTP Mixture、MgCl2等),然后再分装到每个反应管中。这样,可使所取的试剂体积更准确,减少试剂损失,避免重复分取同一试剂。同时也可以减少实验操作或实验之间产生的误差。
2. 使用Reverse Transcriptase (AMV)、RNase Inhibitor、TaKaRa LA Taq 等试剂时,应轻轻混匀,避免起泡;分取之前要小心地离心收集到反应管底部;由于酶保存液中含有50%的甘油,粘度高,分取时应慢慢吸取。
3. 酶制品应在实验前才从-20℃中取出,使用后也应立即放回-20℃中保存。
4. 分装试剂时务必使用新的枪头,以防止样品间污染。
5. PCR反应条件
最适的PCR条件因PCR扩增仪的不同而不同,建议在进行样品实验前先试做一下Control实验。
6. 引物选择
用于反转录的引物可视实验具体情况选择Random 9 mers、Oligo dT-Adaptor Primer或特异性下游引物。对于不具有Hairpin构造的短链mRNA,3种引物中的任何一种都可以使用,但一般应按以下方法进行选择。 |
|
Random 9 mers
|
适用于长的或具有Hairpin构造的RNA。包括rRNA、mRNA、tRNA等在内的所有RNA的反转录反应都可使用本引物。
用Random 9 mers合成的cDNA进行PCR反应时,使用任何一对特异性引物都能获得良好的扩增。 |
|
Oligo dT-AdaptorPrimer
|
适用于具有Poly(A)+ Tail的RNA。(注意:原核生物的RNA、真核生物Primer 的rRNA及tRNA以及某些种类的真核生物的mRNA不具有Poly(A)+ Tail)。本Primer设计巧妙,反转录效率高。反转录反应后,可用M13 Primer M4进行3’-RACE实验。 |
|
特异性下游PCR Primer
(PCR时的下游引物)
|
因其必须与模板序列互补,所以只适用于Target序列已知的情况。 |
|
|
| |
| |







.png)