| |
| ■ 制品说明 |
本制品是从Corynebacterium sp. OZ-21培养上清液中制备而来的复合酶。
◇ 具有良好的热稳定性
◇ 具有Chitinase、Chitobiase酶活性
◇ 可制备丝状真菌的原生质体
对于一些难处理的黑曲霉等丝状真菌,建议使用Yatalase -Plus-(Code No. T030) |
| |
| ■ 保存 |
| 4℃,干燥条件。 |
| |
| ■ 形态 |
| 干粉(含乳糖作为辅料) |
| |
| ■ 酶活性 |
Chitinase活性: 50 U/g powder 以上
Chitobiase活性:500 U/g powder 以上
细胞壁溶解活性: 约10,000 U/g powder |
| |
| ■ 起源 |
| Corynebacterium sp. OZ-21 |
| |
| ■ Chitinase活性测定 |
| 活性定义:在下述条件下,1分钟释放1 μmol的游离N –Acetylglucosamine所需要的酶量定义为1 U。 |
| 测定方法: |
| 试剂A:醋酸缓冲液 |
| |
在90 ml 蒸馏水中溶解0.82 g的醋酸钠。在溶液中逐次少量加入醋酸调节pH至6.0。定容至100 ml,该溶液即为0.1 M醋酸缓冲液。 |
| 试剂B:基质液 |
| |
在A液中加入0.5%的Chitin制成基质液。 |
| 试剂C:酶液 |
| |
加蒸馏水溶解使其终浓度为0.8 mg/ml。 |
| 操作步骤 |
1. 在L型实验管中加入1 ml 试剂B,37℃孵育5~10分钟。
2. 添加0.2 ml试剂C后,37℃轻柔振荡反应1小时。
3. 加热失活(煮沸5分钟)后,3,000 rpm离心10分钟,通过Reissig法测定上清中的N-Acetylglucosamine的量。
4. 通过标准曲线计算出酶反应释放的游离N-Acetylglucosamine量。 |
|
|
|
|
| |
| ■ Chitobiase活性测定 |
| 活性定义:在下述条件下,1分钟释放1 μmol游离的p-Nitrophenol所需的酶活性定义为1 U。 |
| 测定方法: |
| 试剂A:MclLvaine缓冲液 |
| |
0.1 M柠檬酸(柠檬酸2.1 g溶解于蒸馏水中定容至100 ml)中加入0.2 M磷酸氢二钠溶液(十二水合磷酸氢二钠10.74 g溶解于蒸馏水中定容至150 ml)并调整pH为6.0。 |
| 试剂B:基质液 |
| |
将8.56 mg p-Nitrophenyl-N-acetyl-β-D-glucosaminide 添加到5.0 ml A液中使其溶解。 |
| 试剂C:酶液 |
| |
加蒸馏水溶解使其终浓度为0.8 mg/ml。 |
| 试剂D:反应停止液 |
| |
碳酸钠(无水)2.65 g 加蒸馏水溶解后定容至100 ml。 |
| |
| 操作步骤 |
1. L型反应管中添加0.75 ml试剂A和0.2 ml试剂B,37℃孵育5~10分钟。
2. 加入50 μl试剂C,迅速将反应管混匀后开始反应。
3. 10分钟轻柔振荡后,添加2.0 ml试剂D,迅速混匀后,在405 nm测定吸光度。
4. 通过标准曲线计算酶反应释放出的游离p-Nitrophenol的量。 |
|
|
|
|
| |
| ■ 细胞壁溶解活性测定 |
| 活性定义:在下述条件下,1小时内引起溶液于660 nm处吸光度减少1%时所需的酶量定义为1 U。 |
| 测定方法: |
| 试剂A:基质液 |
| |
收集Aspergillus oryzae菌体(Dextrin-Peptone培养基,25~30℃培养1-2天)并使用Waring搅拌器匀浆(16,000 rpm,3 min)。之后使用French press(弗氏压碎器)将菌体压成碎片,在滤纸上充分水洗后,再使用丙酮和乙醚洗涤。风干沉淀后添加0.1 M醋酸缓冲液(pH6.0)将其溶解成终浓度为0.125%(w/v)的悬浊液,此为基质液。 |
| 试剂B:酶液 |
| |
加蒸馏水溶解使其终浓度为0.8 mg/ml。 |
| |
| 操作步骤 |
1. 反应管中加入4 ml试剂A。
2. 添加1 ml 试剂B后,迅速混匀,于37℃轻柔振荡培养1小时。
3. 迅速检测660 nm波长下溶液的吸光度。 |
|
|
|
|
| |
| ■ 一般性质 |
最适pH : pH7.2
最适温度 : 37℃ |
| |
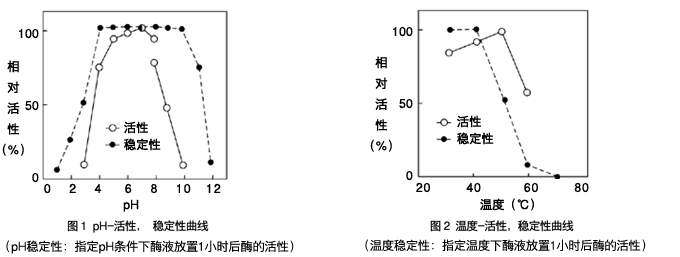 |
| |
| 表1:各种酶活性 |
| 酶 |
活性(U/g powder) |
| Chitinase |
>50 |
| Chitobiase |
>500 |
| Chitosanase* |
19 |
| β-1,3-Glucanase* |
300 |
| Protease* |
31 |
| 细胞壁溶解活性 |
10,000 |
|
|
| * Chitosanase、β-1,3-Glucanase、Protease的值为代表性的样品值,不是标准值。 |
| |
| 本制品由Ozeki corporation制造。 |
| |
| |



